
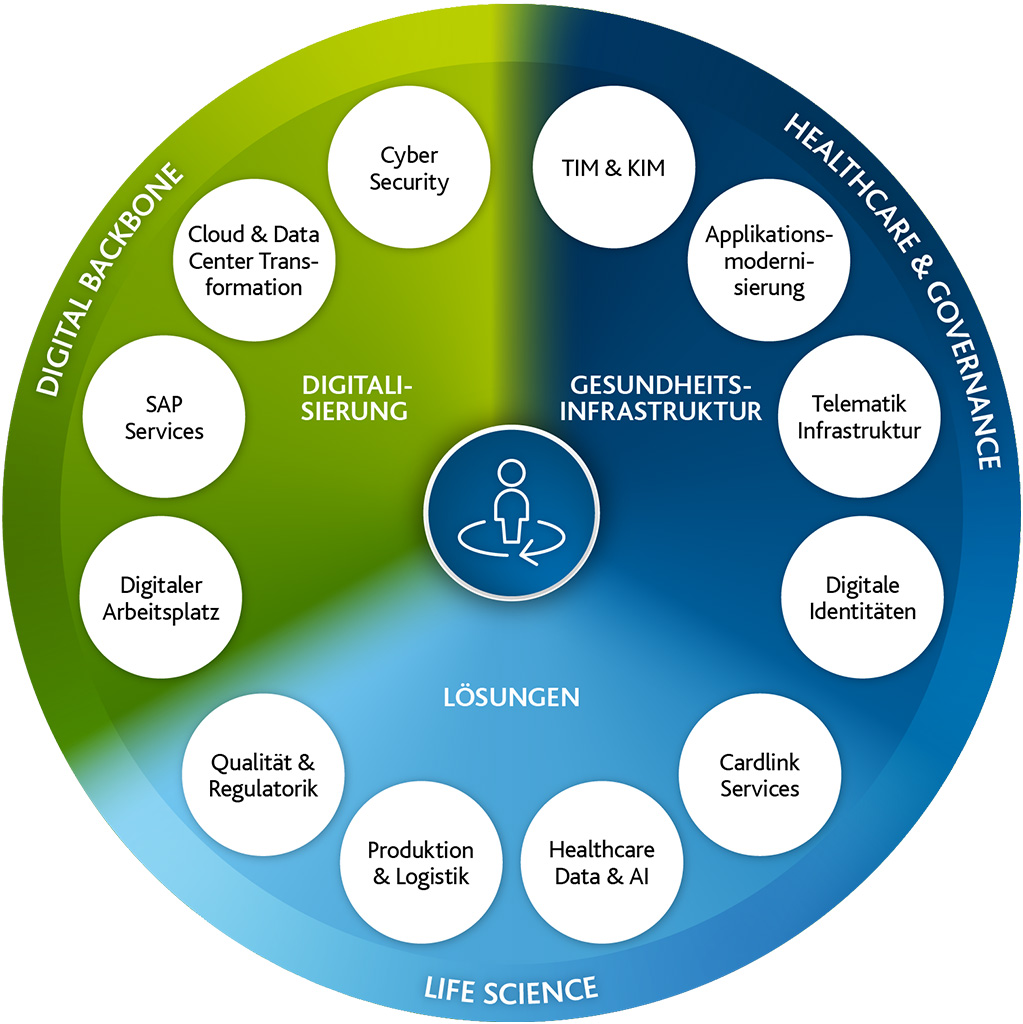
Digitalisierungspartner für das Gesundheitswesen und die Life Science-Branche
Zukunftssicher: Unsere digitalen Lösungen für Healthcare und Life Science
Wir verbessern die Gesundheitsversorgung. Digital.
Denn mit unseren Lösungen verfolgen wir das Ziel, die Gesundheitsbranche zukunftsfähiger zu gestalten und Geschäftsprozesse in der Life Science-Industrie zu optimieren. Als Vordenker unterstützen wir Unternehmen im Gesundheitswesen dabei, dem Kostendruck standzuhalten und die Vorteile der Digitalisierung optimal zu nutzen. Wir begegnen unseren Kunden auf Augenhöhe und begleiten sie partnerschaftlich bei der Cloud- sowie Outsourcingstrategie.


Mit NAVOO® haben wir unser Ziel erreicht, für die B. Braun-Mitarbeiter mit nur einer innovativen Lösung eine effiziente und sichere weltweite Zusammenarbeit zu gewährleisten. Die Zufriedenheit unserer Mitarbeiter in der täglichen Teamarbeit spricht für den Erfolg des Projekts.
Wissenswertes
-
Was ist die Telematikinfrastruktur der gematik?
Die Telematikinfrastruktur (TI) der gematik ist eine sichere, deutschlandweite Plattform im Gesundheitswesen, die es erlaubt, digitale Anwendungen und medizinische Daten zwischen verschiedenen Leistungserbringern wie Ärztinnen und Ärzten und allen weiteren Mitarbeitenden der Branche auszutauschen. Die TI ist Teil der Digitalisierungsstrategie im Gesundheitswesen und soll die Qualität der medizinischen Versorgung verbessern sowie die Effizienz und die Patientensicherheit erhöhen. Betrieben werden die zentralen Dienste der TI seit 2015 von Arvato Systems.
Die konsequente Weiterentwicklung der Telematikinfrastruktur auf Basis einer Zero-Trust-Infrastruktur (TI 2.0) verringert die Komplexität und sorgt für ein nutzerfreundliches, flexibleres, dynamisches digitales Gesundheitswesen.
-
Welche Anwendungen laufen in der Telematikinfrastruktur?
Hier sind einige Beispiele für Anwendungen, die in der TI laufen:
Elektronische Patientenakte (ePA): Die ePA ist eine digitale Gesundheitsakte, in der Patientinnen und Patienten ihre medizinischen Daten speichern können. Als Anwendung der TI soll sie den Austausch von Gesundheitsdaten zwischen verschiedenen Gesundheitsdienstleistern erleichtern.
Elektronische Arbeitsunfähigkeitsbescheinigung (eAU): Die eAU ist eine digitale Arbeitsunfähigkeitsbescheinigung, die von Ärztinnen und Ärzten ausgestellt wird und über die TI an die Krankenkassen übermittelt wird.
Elektronische Medikationspläne (eMP): Der eMP ist ein digitaler Medikationsplan, der wichtige Informationen über die Medikation einer Patientin oder eines Patienten enthält. Der eMP soll dazu beitragen, Medikationsfehler zu vermeiden.
Notfalldatenmanagement (NFDM): Das NFDM ist ein Verzeichnis, in dem wichtige medizinische Informationen von Patientinnen und Patienten gespeichert werden. Das NFDM ermöglicht im Notfall schnelle und gezielte medizinische Hilfe.
E-Rezept: Das E-Rezept wird digital erstellt sowie signiert und die Ausstellung ist für alle gesetzlich Versicherten vorgeschrieben. Der Rezeptcode kann entweder auf dem Smartphone oder durch einen Ausdruck bei einer Apotheke eingelöst werden. Die Nutzung der App ermöglicht Patientinnen und Patienten einen sicheren, datenschutzkonformen Zugang zu Rezeptdaten.
Weitere Anwendungen sind beispielsweise KIM (Kommunikation im Medizinwesen), TIM (TI-Messenger), ISiK, oder DEMIS.
-
Was ist die FMD?
Die Abkürzung FMD steht für die Fälschungsschutzrichtlinie für Arzneimittel (englisch: Falsified Medicines Directive). Die FMD ist eine EU-Richtlinie, die im Februar 2019 in Kraft getreten ist und zum Ziel hat, Verbraucherinnen und Verbraucher vor gefälschten Arzneimitteln zu schützen.
Die FMD sieht vor, dass alle verschreibungspflichtigen Arzneimittel, die in der EU hergestellt oder importiert werden, mit einem eindeutigen Identifikator versehen werden müssen. Der Identifikator besteht aus einem zweidimensionalen Data-Matrix-Code, der Informationen wie die Produktbezeichnung, die Chargennummer und das Verfallsdatum enthält. Die Daten werden in einer europaweiten Datenbank gespeichert und können von den Herstellern, Großhändlern, Apotheken und Überwachungsbehörden abgerufen werden. Die FMD stellt somit sicher, dass nur echte und sichere Arzneimittel ausgeliefert werden.
-
Wie funktioniert ein strategischer Weg in die Cloud?
Eine moderne IT-Infrastruktur ist für die Erreichung von Unternehmenszielen und Wettbewerbsvorteilen von entscheidender Bedeutung. Flexibilität und Anpassungsfähigkeit, Kostenreduzierung, Effizienzsteigerung, Cyber Sicherheit und Datenschutz sind nur einige Gründe, warum Unternehmen sich für die Cloud entscheiden sollten.
Um die Vorteile einer modernen Cloud-IT in Anlehnung an die Geschäftsanforderungen voll ausschöpfen und gleichzeitig Risiken minimieren zu können, muss die bestehende IT-Landschaft individuell betrachtet und eine passgenaue Roadmap auf Applikationsebene entwickelt werden. Je nach Applikation und Geschäftsrelevanz ergeben sich im Regelfall unterschiedliche Migrations- und Betriebsszenarien, die bedarfsgerecht realisiert werden müssen.
-
Was ist die Souveräne Cloud?
Ziel einer souveränen Cloud ist es, die Abhängigkeit von ausländischen Cloud-Providern zu reduzieren und die Kontrolle über die eigenen Daten zu behalten. Dabei sollte sichergestellt sein, dass eine direkte Zugriffsmöglichkeit von außen durch technische Maßnahmen ausgeschlossen wird. Der Betrieb kann dabei durch die Regierung selbst erfolgen oder durch eine ausgewählte Organisation. Dies ist besonders wichtig für Regierungsbehörden, kritische Infrastrukturen und andere Organisationen, die mit sensiblen Daten arbeiten. Somit haben auch diese die Möglichkeit, global etablierte Technologien unter lokalen Souveränitätskriterien einzusetzen.
-
Wie funktioniert eine Cyber Erpressung in der Gesundheits- und Life Science-Branche?
Cyber-Erpressung in der Gesundheits- und Pharmabranche kann auf unterschiedliche Wege stattfinden. Hier sind einige Beispiele:
Ransomware: Angreifer:innen dringen in das IT-System eines Gesundheits- oder Life Science-Unternehmens ein und verschlüsseln wichtige Dateien oder Systeme. Sie fordern dann ein Lösegeld, um die verschlüsselten Daten wiederherzustellen.
Datenlecks: Dabei werden sensible Daten aus den Systemen der Unternehmen gestohlen und damit gedroht, die Daten öffentlich zu machen. Um die Daten zurückzubekommen, wird ein Lösegeld gefordert.
DDoS-Angriffe: Ein Angreifer oder eine Angreiferin führt Distributed-Denial-of-Service-Angriffe (DDoS) gegen die Systeme durch, um die Verfügbarkeit zu beeinträchtigen. Er oder sie fordert anschließend ein Lösegeld, um die Angriffe zu beenden.
Social Engineering: Cyberkriminelle geben sich als Mitarbeiter oder Mitarbeiterin des Gesundheits- oder Life Science-Unternehmens aus und fordern vermeintliche Kolleginnen oder Kollegen auf, sensible Informationen oder Geld zu übermitteln.
Zertifizierungen
Verlassen Sie sich auf uns: Informationssicherheit, Qualitätsmanagement, IT-Service-Management. Für unsere Kunden lassen wir uns regelmäßig an unseren Leistungen messen und umfangreich zertifizieren. Von der Einhaltung höchster Qualitätsstandards sowie unserer technologischen Kompetenz profitieren Sie langfristig in Form einer vertrauensvollen und hochprofessionellen Zusammenarbeit.
Ihr Kontakt für Gesundheitswesen & Life Science










































